CRB(認定臨床研究審査委員会)審査資料は、特定臨床研究を行う際に、実施計画や研究計画の詳細な情報を提供する文書。NATACO は、研究事務局支援業務を受託できる CRO(医薬品開発業務受託機関)が日本国内に少ないことを課題に、特定臨床研究に特化した CRO として誕生しました。契約期間内に完了することができ、経済合理性の観点から研究の効率化を図ります。
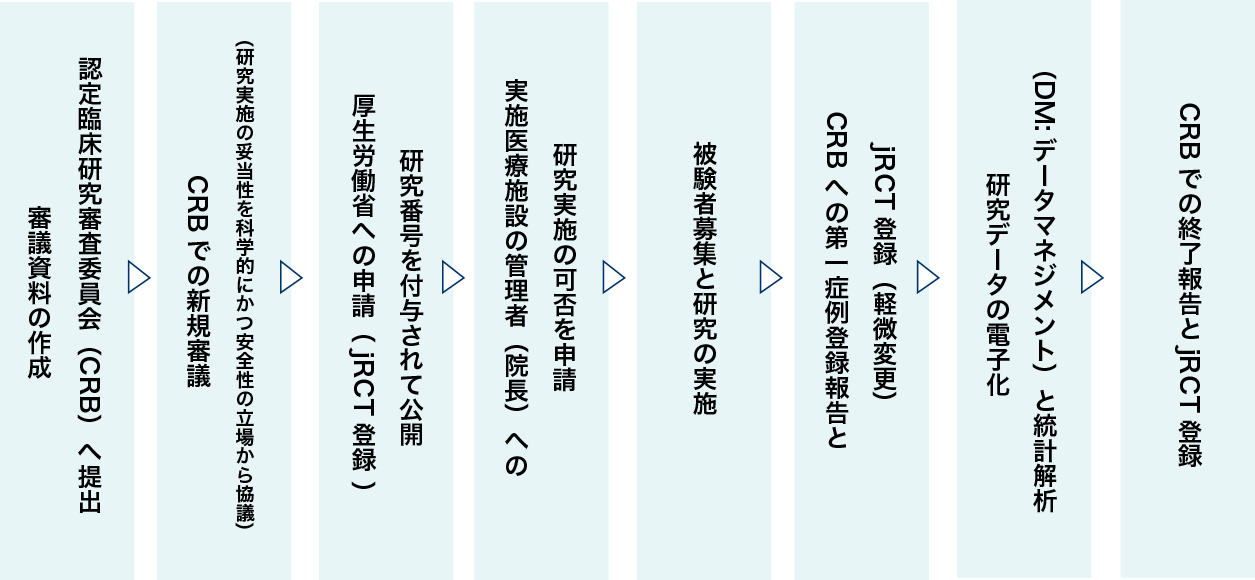
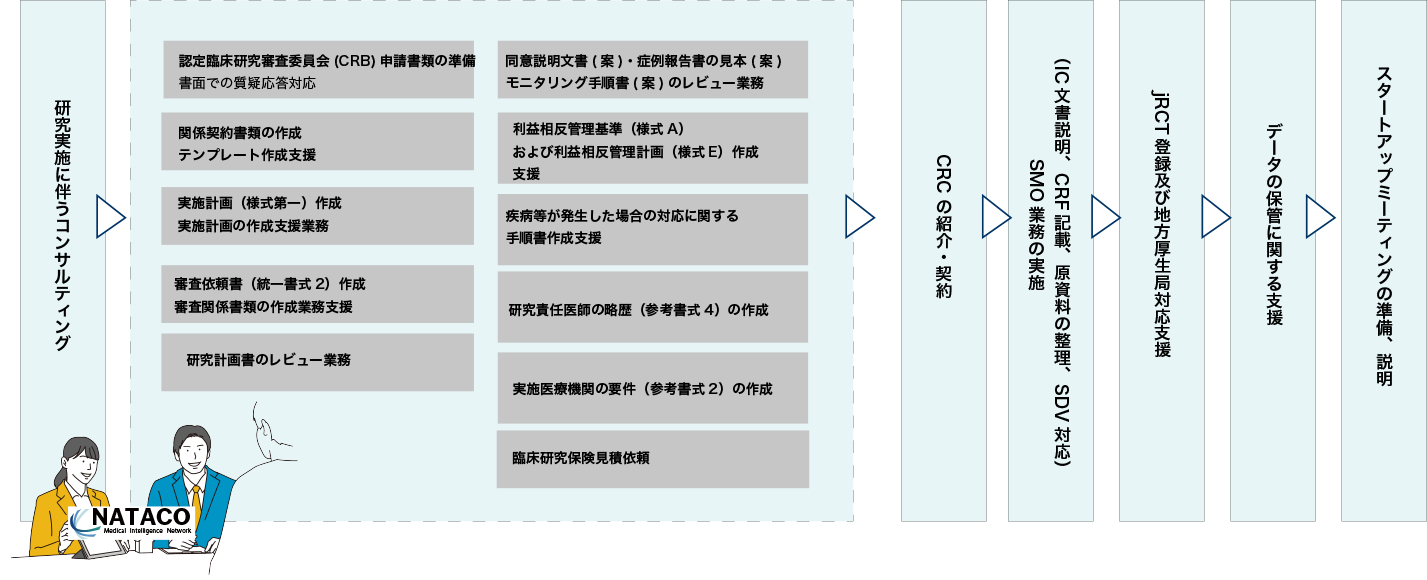
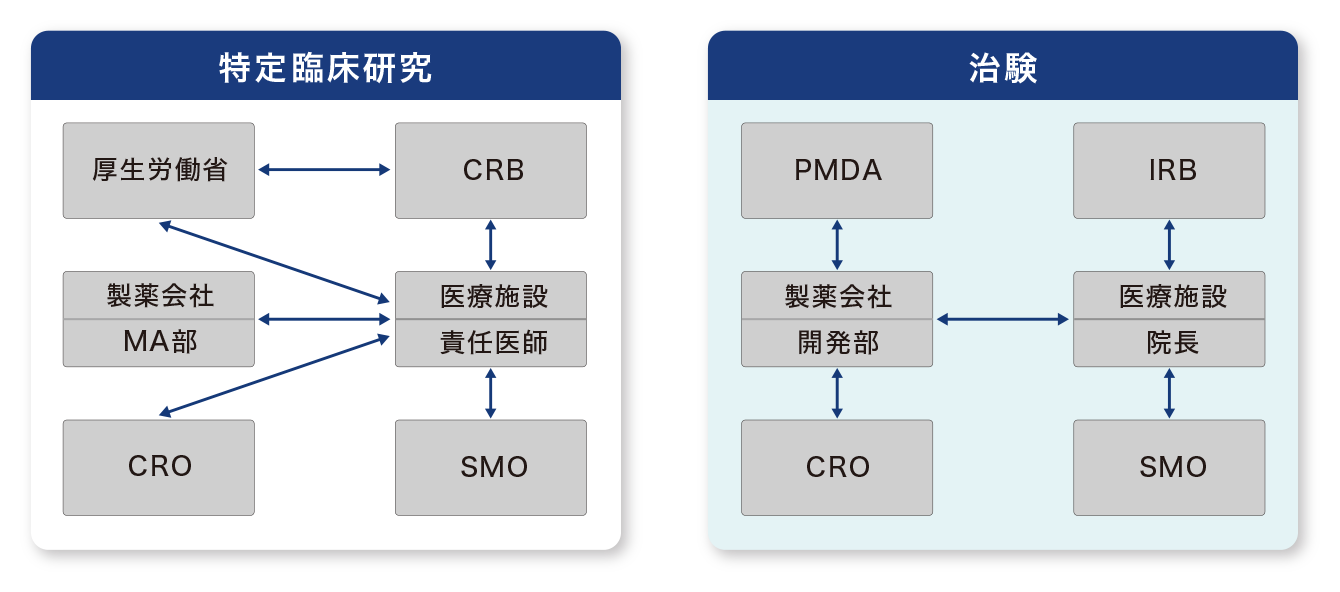
NATACO は研究事務局支援に必要な業務を契約期間内に完了することができますので経済合理性の観点から効率が上がります。実施医療施設で研究責任医師に必要な業務は、認定臨床研究審査委員会(CRB)への新規審議依頼から終了報告までの手続き、 jRCT 登録(地方厚生局対応)、臨床保険の契約、DM(データマネジメント)など外注先の管理、研究協力者の管理です。
NATACO には特定臨床研究の CRB 審議件数 70 件、研究事務局支援業務 11 件の実績を持つスタッフが常駐しています。これまでの CRB 事務局経験から研究事務局支援業務を完璧に受託できる CRO(医薬品開発業務受託機関)が国内に少ないことを理由に、NATACO は特定臨床研究に特化した CRO として 2022 年 3 月に設立されました。NATACO のスタッフは臨床試験の業界で 30 年の経験があり、研究事務局支援業務に長けているため、依頼内容についての理解が深く、クライアントの要望に対する理解が深いため、アウトソーシング先として最適です。
審議のための資料の作成が急務である場合、また、特定臨床研究を実施する場合にスケジュール的にタイトで、作業工数が院内で確保できない場合に研究事務局支援業務をアウトソーシングをすることでスピードアップすることができます。